-
Let it Bee
② 봉독에서 간치료의 길 찾기

Who is 권소영?
원광대학교 한의과대학 졸업
현 원재한의원 부원장
현 비플러스 봉독연구소 연구원
kwonso_0@naver.com
꿀벌과 함께한 인류역사는 꿀과 함께 달콤해졌습니다. 꿀벌은 농작물의 수분을 매개하여 우리의 먹거리를 풍부하게 해주었으며,
꿀벌이 모아주는 꿀은 귀한 약으로, 최고의 음식으로, 화장품으로 쓰였고 부패를 막아주는 방부제로도 쓰였습니다.
또, 밀랍으로 만든 초는 다른 재료로 만든 어떤 것과도 비교할 수 없을 만큼
견고하게 높은 온도를 견뎌 주는 것으로 우리의 어두운 밤을 환하게 밝혀주었습니다.
더불어 꿀벌이 우리에게 주는 혜택 중 가장 최근에 효용성을 인정
받아 연구로 진행 중인 것이 있습니다.
바로 ‘봉독’입니다. 다른 양봉산물에 비해 비교적 생소하지만
봉독은 성분 활성도 및 의학적활용 잠재력이 뛰어나 의료과학 부문에서 큰 주목을 받고 있습니다.
봉독은 꿀벌의 독낭에 존재하는데, 약 40여 가지의 다양한 성분으로 구성되어 있는
복합체로1) 한의학에서는 각종 염증성 질환과 통증 질환에 활용하는 성분 중 하나입니다.2)
지난 호에는 봉독의 주요한 효능인 소염진통기전에 대해 알아보았습니다.
이번 호에서는 봉독의 잘 알려지지 않은 효능 중 우리가 주목해야 할 ‘간세포 보호 효과3-6)’에 대해 이야기해보려 합니다.
‘봉독’은 주입될 때 느껴지는 따끔한 자입감과 이름에 포함된 ‘독(毒)’이라는 글자 때문에 독성(toxic) 이미지를 지니고 있습니다.
따라서 인체에 흡수되는 모든 물질을 해독하는 ‘간’에 해로울 것이라는 오해가 많습니다.
하지만 실제로는 그렇지 않다는 것을 최근 연구 발표된 관련 논문들을 통해 알아보도록 하겠습니다.
 간세포의 운명은 세포자멸사(Apoptosis)로 결정된다
간세포의 운명은 세포자멸사(Apoptosis)로 결정된다
간세포는 생리적 조건하에서는 분열능력을 발휘하지 않습니다. 그러나 태생기나 간이 절제되었을 때, 인(P) 중독이나 염
증에 의한 고도의 간세포 장애 상황에서는 왕성한 세포 분열에 의한 증식과 재생능력을 발휘합니다.7) 간세포가 손상되
면 세포 수 조절이 가장 큰 영향을 받는데, 세포 수 조절은 대부분 세포자멸사(apoptosis)를 통해 이루어집니다.
세포자멸사란 세포가 스스로 죽기를 결정하고 생체에너지인 ATP를 적극적으로 소모하면서 죽음에 이르는 과정입니다.
이 과정에서 세포가 쪼그라들고, 세포 내의 DNA가 규칙적으로 절단됩니다. 쪼그라들어 단편화된 세포 조각들을 주변의
식세포가 잡아먹는 것으로 세포자멸사의 과정은 종료됩니다. 세포자멸사는 병적, 생리적 과정에서 모두 발생하는 세포
수 조절 방법 중 하나인데, 생리적 과정에서 발생하는 세포자멸사의 예로는 올챙이가 개구리가 되면서 꼬리가 사라지는
것을 들 수 있습니다. 병적 과정에서 발생하는 세포자멸사로는 세포가 심각하게 훼손돼 암세포로 변할 가능성이 있을 때
전체 개체를 보호하기 위해 암세포 자살기전이 발현하는 것을 들 수 있습니다.
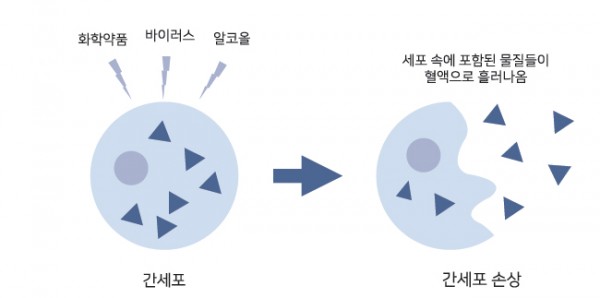
그림 2. 간세포가 파괴되면 세포 속에 포함된 물질들이 혈액으로 흘러나온다.
간세포에서 일어나는 세포자멸사는 화학약품, 바이러스 감염, 알코올 등으로 세포가 손상될 때 일어나게 됩니다. 세포
는 이를 감지하고 스스로 세포자멸사를 통한 자살을 결정하는데, 이때 간세포가 파괴되면서 세포 내 효소인 AST, ALT
가 방출됩니다. 따라서 AST, ALT는 가장 기본적인 간기능 검사 항목이 됩니다. 간기능 검사는 혈액검사 결과를 통한 간,
담관계 질환의 간접적 증거가 되므로 기존의 간질환에 대한 경과를 관찰할 때, 또 간질환이 의심될 때 초기 평가도구로
활용합니다.8) 적절하게 이루어지는 세포자멸사는 신체에 꼭 필요한 기전이지만 과도한 세포자멸사와 염증반응은 간세
포전체의 기능에 영향을 주고 만성화될 때는 간섬유증 등으로 진행하게 됩니다. 따라서 과잉된 세포자멸사의 활성을 억
제할 필요가 있습니다. 여기서 봉독은 세포자멸사의 주 요소인 bcl-2 family와 caspase family를 조절하여 과잉된 세
포자멸사를 억제하고 간세포 보호 효과를 발휘합니다. 봉독이 뭘 어떻게 조절하는지 알기 위해, 적의 정체를 파헤치는
것이 필요합니다.
 Bcl-2 family와 Caspase family는 어떤 패밀리인가?
Bcl-2 family와 Caspase family는 어떤 패밀리인가?
1. Bcl-2 family
Bcl-2 family는 미토콘드리아에 의한 intrinsic apoptosis pathway에 작용하는 단백질로, 작용에 따라 prosurvival
regulator와 pro-apoptosis regulator로 나눌 수 있습니다. 이들은 주로 미토콘드리아에서 작용하는데
pro-apoptosis regulator는 cytochrome C의 유출에 관여함으로써 세포자멸사를 일으키고 pro-survival는 반대로
cytochrome C의 유출을 막아 세포자멸사를 막아줍니다. Bcl-2 family의 구성은 다음의 표와 같습니다.
Bcl-2 family의 구성 |
||
Pro-survival regulator |
Bcl-2 sub-family |
Bcl-2 |
Bcl-xL |
||
Bcl-w |
||
Mcl-1 |
||
A1/Bfl-1 |
||
Pro-apoptosis regulator | Bax sub-family | Bax |
Bak | ||
Bak | ||
BH3 sub-family | Bik/Nbk/Blk | |
Hrk/DP5 | ||
BIM | ||
Noxa | ||
Bad | ||
Puma/Bbc3 | ||
Bmf | ||
EGL-1 | ||
BID | ||
표 1. Bcl-2 family의 구성
Bcl-2 family 중 실제적으로 세포의 생존에 관여하는 것은 Bcl-2 sub-family입니다. 하지만 Bcl-2 sub-family의 정확한 작용 기전을
이해하기 위해서는 Bax sub-family와 BH3 sub-family의 작용에 대해서도 알아두어야 합니다.
1) Bax sub-family
Bax와 Bak는 평상시에는 단량체로 존재하면서 Bcl-2에 의해 그 작용이 저해됩니다. 그러다 세포자멸사 신호가 들어오면, 형태의
변화가 일어나고 이합체를 형성하여 미토콘드리아 외막에 구멍을 만들어 내부의 물질을 밖으로 유출시킵니다. 이때 나오는 물질은
cytochrome C, Apaf-1, Smac/Diablo, AIF 등으로 모두 세포자멸사에 작용하는 물질들입니다.
2) BH3 sub-family
이 family는 BH3 domain만을 가지고 있어 BH3 only protein으로 분류되기도 합니다. 이들은 세포자멸사 신호가 들어오면 Bcl-2,
Bcl-xL에 결합하여 그 작용을 억제함으로써 Bax와 Bak의 작용을 활성화시킵니다. 특히 BID의 경우 평상시에는 아무 작용이 없다가 세
포자멸사 신호에 의해 활성화된 caspase-8에 의해 일부가 잘려 tBID가 되고, Bcl-xL에 작용을 하게 됩니다.
3) Bcl-2 sub-family
평상시에 Bcl-2는 BH3 sub-family인 BID/BIM과 결합되어 있고 Bax, Bak은 아무것도 결합되어 있지 않은 상태로 미토콘드리아 외막
에 존재합니다. 세포자멸사 신호가 들어오게 되면 Bad가 Bcl-2와 결합하게 되고 Bcl-2로부터 떨어져 나온 BIM은 Bax와 결합하여 그
들 형태의 변화를 유도하여 세포자멸사를 유발시킵니다. 즉, Bcl-2는 Bax sub-family와 BH3 sub-family의 작동을 억제하여 세포자
멸사를 막는 것입니다.
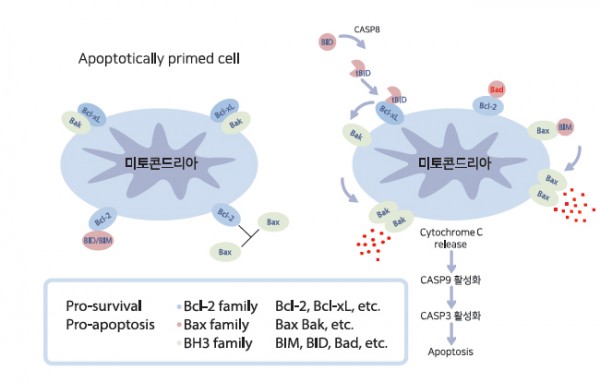
그림 3. Bcl-2 family 활성을 통한 세포자멸사 기전
2. Caspase family
Caspase family는 세포 내에 존재하는 cytosolic protease series로 세포자멸사에 필수적인 단백입니다. caspase는 정상적
으로 핵과 미토콘드리아의 외막에 불활성 상태인 proenzyme 형태로 존재하다가, cytochrome C에 의해 활성화되면 직접 또
는 간접적으로 세포내에 존재하는 많은 표적 단백질을 분해합니다. 따라서 caspase family는 DNA분절화 현상과 핵의 응축
등 세포자멸사의 형태적 특징을 주로 발현시키는 역할을 합니다.
세포자멸사 신호에 의해 활성화된 caspase-8은 BID를 tBID로 만듭니다. tBID는 Bcl-xL에 작용하여 Bcl-2 family 중 proapoptosis
조절 단백인 Bak를 활성화시키는 역할을 합니다. 그리고 BIM과 결합한 Bax는 올리고머화를 거쳐 세포막에 구멍
을 내고, cytochrome C의 해리가 유도되면 caspase family 중 caspase-9이 먼저 활성화됩니다. 활성화된 caspase-9은
caspase-3 등을 활성화시키고 결국 세포자멸사를 일으키게 됩니다.
 봉독은 어떻게 간세포 보호효과를 내는가?
봉독은 어떻게 간세포 보호효과를 내는가?
봉독은 pro-inflammation 사이토카인인 TNF-α, IL-1β, TGF-β①를 억제하여 염증발현 신호 및 세포자멸사 발현 신호를 차
단합니다.4,9-12) 또한 봉독은 염증 발현 신호 경로인 NF-κB를 차단하여 염증발현 전사를 억제합니다.13)14)15)
① Transforming growth factor(TGF)-β는 세포의 변화, 성장, 세포자멸사를 매개하는 인자로, TGF-β가 발현되면 세포생존을 감소시키고
세포자멸사를 유도한다.
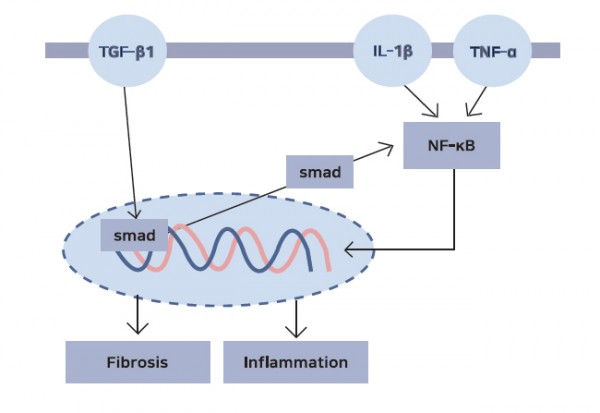
그림 4. pro-inflammation 사이토카인의 작용으로 NF-κB가 활성화되어 핵 안으로 들어가면
염증, 섬유증을 유발하는 신호가 전사된다
그리고 세포자멸사 발현 신호의 핵심인 bcl-2 family를 조절하여 세포자멸사를 억제합니다. 아래 그림과 같이 pro-survival인
자인 bcl-2와 bcl-xL의 발현을 증가시키고 pro-apoptosis인자인 bax, cytochrome C, caspase-3, caspase-9의 발현은
감소시킵니다.3,5)
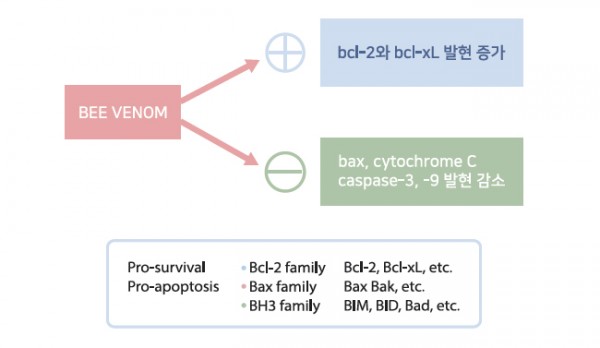
그림 5. 봉독은 bcl-2 family를 조절하여 세포자멸사를 억제한다
 봉독의 소염효과는 간세포에서도 통한다!
봉독의 소염효과는 간세포에서도 통한다!
염증반응은 기본적으로 세포 손상에 대한 수복현상 중 하나입니다. 스트레스로 받아들여지는 기타 자극에 의해 세포가 손상되
고, 손상 수복을 위해 염증반응, 세포자멸사 반응, 세포괴사 반응, 세포자가탐식 반응, 세포섬유화 반응 등이 선택적으로 발생합
니다. TNF-α 차단을 통해 염증유발신호를 차단하고, NF-κB를 차단하여 염증발현 전사를 억제하여 봉독의 특장점인 소염효
과를 간세포에서도 발휘하게 됩니다.
NF-κB는 만성 염증성 질환의 발달에서 중요한 역할을 하는 핵 전사 인자로16) 이 전사 인자는 pro-inflammatory 사이토카인
에 반응하여 활성화되는 주요 신호 전달 경로 중 하나입니다. 또한 이 경로의 활성화는 다양한 성장 인자를 코딩하는 유전자의
조절을 통해 염증에 핵심적인 역할을 합니다.13) 봉독의 멜리틴은 NF-κB의 신호 전달 경로를 차단하여 간세포의 염증반응을
억제합니다.14,15)
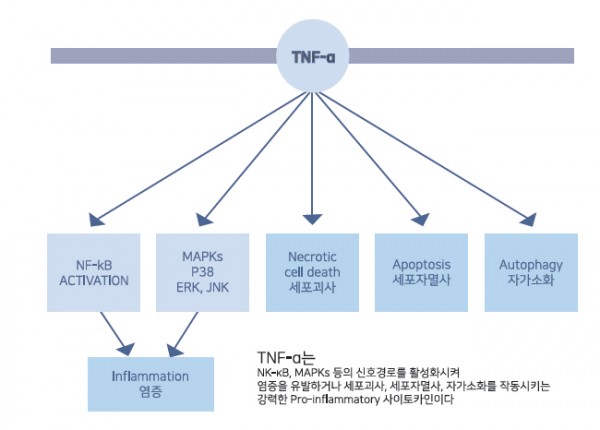
그림 6. TNF-α는 강력한 Pro-inflammatory사이토카인이다.
 봉독은 간섬유증(Liver fibrosis)도 완화시킨다
봉독은 간섬유증(Liver fibrosis)도 완화시킨다
간섬유증은 바이러스성 간염, 알코올성 간염 및 원발성 경화성 담관염을 포함한 다양한 만성 간 질환에서 동반되는데,17) 이러한
간섬유증은 궁극적으로 장기기능을 손상시키는 조직구조와 세포외 기질 구성의 변화를 유발합니다.18-21) 간의 섬유 형성 과정
은 상처 치유 과정과 유사합니다. 즉, 바이러스 감염, 알코올 또는 약물 독성 또는 간세포에 손상을 일으키는 기타 요인에 의해
간에서 염증 반응이 나타나고,15) 간세포 손상을 수복하기 위해 발생하는 급성염증반응은 세포괴사와 세포질 기질에 손상을 남
기게 되고, 이 때문에 간섬유증이 발생하는 것입니다.22) 현재 상기 간섬유증을 동반하는 간 질환의 발병기전은 세포자멸사와 관
련이 있다고 알려져 있습니다.23)
봉독은 앞서 언급한 염증 및 세포자멸사를 억제하여 간섬유증을 완화시킬 수 있고, 추가로 EMT(Epithelial Mesenchymal
Transition, 상피간엽이행) 및 섬유화 유발 사이토카인 발현도 억제하여 간섬유증을 완화시킵니다. 성인의 간세포는 활성화된
섬유아세포의 축적에 EMT 역할을 수행합니다.24,25)(EMT란 상피세포가 상피세포의 성질을 잃고, 형태학적 변화를 거쳐 간엽
성질을 획득하는 것입니다.26)) 최근 연구에서, TGF-β1 혹은 CCl4를 처리한 동물 간세포 모델에서 봉독의 apamin을 처리하였
을 때 EMT를 감소시키는 것으로 나타났습니다.27) 봉독은 섬유화 유발 사이토카인인 α-SMA, fibronectin의 발현을 감소시키
고,4) TNF-α와 IL-1β를 감소시키는데, 간섬유증에 나타나는 콜라겐 유전자 발현은 TNF-α의 전사에 의해 조절되고 세포외
기질의 합성은 IL-1β가 자극하므로 결과적으로 봉독은 간섬유증을 완화시키게 됩니다.28)
 봉독은 간기능을 정상으로 향상시켜준다
봉독은 간기능을 정상으로 향상시켜준다
봉독은 간기능 지표 항목인 AST, ALT의 수치를 감소시켜줍니다.4,12) 이것은 간세포 파괴 억제 및 간기능 저하 억제를 의미합니
다. 또한 봉독은 간세포 파괴에서 나타나는 세포 형태의 변화를 저해하고, 세포 생존율도 증가시켜줍니다.5)
LPS와 D-galactosamine을 동시 투여하게 되면 간 뇌병증, 응고장애, 황달, 복수증 등의 급성 간부전 특징 증상이 나타나는
데, 이 약물은 급성 간부전 동물 모델을 준비할 때 주로 사용되는 것입니다. 상기 약물을 투여하면 다양한 염증 유발성 사이토카
인과 간괴사가 진행되고, 항산화 효소가 감소하게 되며, 혈액내의 ALT 수치와 TNF-α의 발현이 증가합니다.
멜리틴은 상기 동물모델의 간에서 발생하는 세포자멸사와 염증반응을 억제하였는데,12) 이는 멜리틴이 급성 간부전 예방에 대안
이 될 수 있음을 보여줍니다.
또한 봉독의 PLA2가 아세트아미노펜(acetaminophen, AAP)을 주입한 동물 모델에서 간기능 장애를 예방하고 항 염증성 사
이토카인 생산을 유도한다는 것이 입증되었습니다.29) 아세트아미노펜이란 타이레놀(tylenol)의 성분 명으로 진통해열제로 널리
사용되는 성분 중 하나입니다. 하지만 간손상에 대한 다수 보고가 발표되었고, 2009년 미국식품의약국(FDA)은 아세트아미노
펜 제제가 간 손상을 초래할 수 있는 잠재적 위험이 있다는 경고를 제품 라벨에 포함하도록 결정하였습니다. 위 연구는 아세트
아미노펜으로 유도한 간손상에 대해 봉독의 PLA2가 간기능 장애를 예방하고 간세포 손상을 억제한다는 내용입니다. 즉 봉독으
로 약품에 의해 나타날 수 있는 약인성 간손상을 치료할 수 있다는 가능성을 시사해주는 것입니다. 잘 따라오셨나요? 봉독은 이
렇게나 많은 일을 할 수 있습니다.
 마치며...
마치며...
간은 생체에서 단백질 합성, 포도당 및 기타 탄수화물 대사, 핵산 대사, 지질 대사, 약물 대사 등을 담당하는 생명유지에 필수적
인 장기입니다. 만성 간질환 환자들은 이러한 기능들을 수행하는 데 어려움을 겪으며, 만성 간질환은 국내 성인병 및 사망의 주
요 원인 중 하나입니다. 따라서 간질환에 대한 병인규명, 예방 및 치료 등에 대한 연구는 매우 중요하다고 할 수 있습니다.
간질환은 연쇄적으로 연결되어 심화되는 특징을 가지고 있습니다. 바이러스, 자가면역 등에 의해 발생된 간염이 치료되지 않고
병기가 길어져서 만성간염이 되고, 만성간염에 의해 간경변, 간암으로 이행할 가능성이 높아진다고 알려져 있습니다. 그 이유는
간질환은 염증으로 시작해서 섬유화까지 연결되는 일련의 연속반응선상에 있기 때문입니다. 외부 자극으로 인해 염증반응이 반
복되고 연쇄적으로 간세포의 괴사반응이 진행하고, 괴사반응으로 간세포수가 감소하며, 간세포 기능이 감소함과 동시에 간 실
질 내에 섬유질이 침착하게 됩니다. 또한 재생 결절이 발생함으로써 간의 구조가 왜곡되어 이에 따른 각종 치명적 합병증이 나
타납니다.
현재 간염에 대한 치료는 바이러스 증식을 억제하는 인터페론제제, 항바이러스 치료와 간기능 개선의 대증치료가 있습니다. 인터페론제제는 바
이러스 단백의 합성을 저해하는 등 항바이러스 작용과 면역조정 작용으로 HCV 및 HBV의 제거를 촉진합니다. 간기능 개선제로는 우루소데옥
시콜린산(ursodeoxycholic acid, UDCA), 글리시리진(glycyrrhizin) 등이 주로 사용됩니다. 우루소데옥시콜린산은 담즙의 생성·분비를 자극
하고 글리시리진은 간세포 세포막의 안정화나 재생을 촉진하여 간세포를 보호하는 역할을 합니다. 기타 간경변에 따르는 증상들은 이뇨제, 이
당류, 항균제, 아미노산제제, 히스타민, H2수용체 길항제 등을 투여하여 완화합니다.
위에서 살펴본 바에 의하면 봉독치료는 소염효과30,31)와 간세포 보호효과3-6)로 지속적인 간세포 파괴를 저지하고 염증반응 진행을 차단합니다.
따라서 간염 및 알코올 및 약인성으로 발생한 간세포 손상을 억제합니다. 또한 만성 간염 환자들이 간경변증으로 진행되는 것을 억제해주고, 간
경변증 환자들의 간세포 기능을 보존함은 물론, 간섬유화 과정을 지연시키며 나아가 간세포암 발생을 억제시켜줍니다.32-34) 또한 멜리틴의 에
이즈바이러스(HIV) 치료에 대한 가능성을 보여주는 봉독의 항바이러스 작용35), 전신적인 면역조정작용, 항혈관신생효과33,36) 등 간질환 환자에
서 봉독약침시술의 타당성에 대한 근거가 다수 보고되고 있습니다. 따라서 봉독은 간치료의 새로운 제안이 될 수 있는 가능성을 가지고 있으며,
지속적인 임상연구를 통해 그 효과가 확인되어야 합니다.
 SUMMARY : 봉독은 간에 좋다
SUMMARY : 봉독은 간에 좋다
참고문헌
1) Kim HW, Kwon YB, Ham TW et al. Acupoint stimulation using bee venom attenuates formalin-induced pain behavior and spinal
cord fos expression in rats. J Vet Med Sci. 2003 ; 65(3) : 349-55.
2) Dunn JD, Killion JJ. Effect of melittin on pituitary-adrenal responsiveness to stress. Acta Endocrinol. 1988 ; 119(3) : 339-44.
3) 이광길, 여주홍, 한상미 등. 봉독이 TGF-β1으로 유도된 간세포 Apoptosis에 미치는 영향. Journal of Apiculture. 2008 ; 23(3) : 191-98.
4) 박지현, 김경현, 한상미 등. 봉독이 간경화 동물 모델에 미치는 영향. Journal of Apiculture. 2007 ; 22(2) : 173-79.
5) 이우람, 박지현, 김경현 등. Melittin이 알코올로 유도된 간세포 Apoptosis에 미치는 영향. Journal of Apiculture. 2009 ; 24(1) : 49-56.
6) Keum D. The protective effects of bee venom phospholipase A 2 o n a ce ta m i n o p h e n - i n d u ce d h e p a to tox i c i t y t h ro u g h
CD4+CD25+Foxp3+ T cells in mice [dissertation]. Seoul : Kyung Hee University. 2014. English.
7) 네이버. 간세포 [Internet]. 경기 : 네이버 [cited 2017 Jun 10]. available from : http://terms.naver.com/entry.nhn?docId=429692&cid=4241 1&categoryId=42411.
8) 권승원, 박준영. KCD 한의임상을 위한 한방내과 진찰 진단 치료가이드. 경기 : 가온해미디어. 2017 : 163.
9) Park JH, Kim KH, Kim SJ et al. Bee venom protects hepatocytes from tumor necrosis factor-alpha and actinomycin D. Arch Pharm Res. 2010 ; 33(2) : 215-23.
10) Park JH, Kim KH, Kim SJ et al. Effect of bee venom on transforming growth factor-beta1-treated hepatocytes. Int J Toxicol. 2010 ; 29(1) : 49-56.
11) Lee WR, Park JH, Kim KH et al. Protective effects of melittin on transforming growth factor-β1 injury to hepatocytes via antiapoptotic mechanism. Toxicol Appl Pharmacol. 2011 ; 256(2) : 209-15.
12) Park JH, Kim KH, Lee WR et al. Protective effect of melittin on inflammation and apoptosis in acute liver failure. Apoptosis. 2012 ; 17(1) : 61-9.
13) De Martin R, Hoeth M, Hofer-Warbinek R et al. The transcription factor NF-kappa B and the regulation of vascular cell function. Arterioscler Thromb Vasc Biol. 2000 ; 20(11) : E83-8.
14) Park JH, Lee WR, Kim HS et al. Protective effects of melittin on tumor necrosis factor-α induced hepatic damage through suppression of apoptotic pathway and nuclear factor-kappa Bactivation. Exp Biol Med. 2014 ; 239(12) : 1705-14.
15) Park JH, Kum YS, Lee TI et al. Melittin attenuates liver injury in thioacetamide-treated mice through modulating inflammation and fibrogenesis. Exp Biol Med. 2011 ; 236(11) : 1306-13.
16) Tak PP, Firestein GS. NF-kappaB: a key role in inflammatory diseases. J Clin Invest. 2001 ; 107(1) : 7-11.
17) Chen MH, Chen JC, Tsai CC et al. The role of TGF-beta 1 and cytokines in the modulation of liver fibrosis by Sho-saiko-to in rat's bile duct ligated model. J Ethnopharmacol. 2005 ; 97(1) : 7-13.
18) Wallace K, Burt AD, Wright MC. Liver fibrosis. Biochem J. 2008 ; 411(1) : 1-18.
19) Kim KK, Wei Y, Szekeres C et al. Epithelial cell alpha3beta1 integrin links beta-catenin and Smad signaling to promote myofibroblast formation and pulmonary fibrosis. J Clin Invest. 2009 ; 119(1) : 213-24.
20) Choi SS, Diehl AM. Epithelial-to-mesenchymal transitions in the liver. Hepatology. 2009 ; 50(6) : 2007-13.
21) Bataller R, Brenner DA. Liver fibrosis. J Clin Invest. 2005 ; 115(2) : 209-18.
22) Friedman SL. Mechanisms of disease: Mechanisms of hepatic fibrosis and therapeutic implications. Nat Clin Pract Gastroenterol Hepatol. 2004 ; 1(2) : 98-105.
23) Kim KH, Kum YS, Park YY et al. The protective effect of bee venom against ethanol-induced hepatic injury via regulation of the mitochondria-related apoptotic pathway. Basic Clin Pharmacol Toxicol. 2010 ; 107(1) : 619-24.
24) Zeisberg M, Yang C, Martino M et al. Fibroblasts derive from hepatocytes in liver fibrosis via epithelial to mesenchymal transition. J Biol Chem. 2007 ; 282(32) : 23337-47.
25) Dooley S, Hamzavi J, Ciuclan L et al. Hepatocyte-specific Smad7 expression attenuates TGF-beta-mediated fibrogenesis and protects against liver damage. Gastroenterology. 2008 ; 135(2) : 642-59.
26) Thiery JP, Sleeman JP. Complex networks orchestrate epithelial-mesenchymal transitions. Nat Rev Mol Cell Biol. 2006 ; 7(2) : 131-42.
27) Lee WR, Kim KH, An HJ et al. Apamin inhibits hepatic fibrosis through suppression of transforming growth factor β1-induced hepatocyte epithelial-mesenchymal transition. Biochem Biophys Res Commun. 2014 ; 450(1) : 195-201.
28) Kim SJ, Park JH, Kim KH et al. Bee venom inhibits hepatic fibrosis through suppression of pro-fibrogenic cytokine expression. Am J Chin Med. 2010 ; 38(5) : 921-35.
29) Kim H, Keum DJ, Kwak Jw et al. Bee venom phospholipase
A2 protects against acetaminophen-induced acute liver injury by modulating regulatory T cells and IL-10 in mice. PLoS One. 2014 ; 9(12) : e114726.
30) Piek T. Venoms of the Hymenoptera. London : Academic Press. 1986 : 330.
31) Habermann E, Reiz KG. On the biochemistry of bee venom peptides, melittin and apamin. Biochem Z. 1965 ; 343(2) : 192-203. German.
32) Mao J, Liu S, Ai M et al. A novel melittin nano-liposome exerted excellent anti-hepatocellular carcinoma efficacy with better biological safety. J Hematol Oncol. 2017 ; 10(1) : 71.
33) Zhang Z, Zhang H, Peng T et al. Melittin suppresses cathepsin S-induced invasion and angiogenesis via blocking of the VEGF-A/ VEGFR-2/MEK1/ERK1/2 pathway in human hepatocellular carcinoma. Oncol Lett. 2016 ; 11(1) : 610-18.
34) Qian CY, Wang KL, Fang FF et al. Triple-controlled oncolytic adenovirus expressing melittin to exert inhibitory efficacy on hepatocellular carcinoma. Int J Clin Exp Pathol. 2015 ; 8(9) : 10403-11.
35) Hood JL, Jallouk AP, Campbell N et al. Cytolytic nanoparticlesattenuate HIV-1 infectivity. Antivir Ther. 2013 ; 18(1) : 95-103.
36) 신재문, 정윤정, 박관규 등. 봉독의 HIF-1α 발현감소를 통한 혈관신생억제효과. 생명과학회지. 2012 ; 22(1) : 41-8.
On Board 2017 SUMMER 'Let it Bee ② 봉독에서 간치료의 길 찾기'
등록된 댓글이 없습니다.